 |
|||||||
|
|||||||
|
М. В. Супотницкий. ВИЧ/СПИД-пандемия. Так с чем же в действительности мы столкнулись?27.08.2010 Михаил Васильевич Супотницкий - кандидат биологических наук Со СПИДом как-то с самого начала обнаружения этой пандемии было все ясно. «Ну, появился новый вирус, но он же не передается через рукопожатие и при чихании, значит и проблем не должно быть» — говорили нам заслуженные победители эпидемий. «Создадим вакцину, и покончим с ВИЧ как недавно с возбудителем натуральной оспой» — говорят хором они сегодня. А пока вакцины нет, то главное в борьбе с пандемией — это безопасный секс, одноразовые шприцы, обеспечение прав ВИЧ-инфицированных, да еще деньги, как можно больше денег на вакцину, на презервативы, одноразовые шприцы и правозащитную пропаганду — и это уже стандарт ВИЧ/СПИД-политики цивилизованного государства. Сегодня вряд ли есть другой микроорганизм, изученный столь обстоятельно как ВИЧ, а результатов в борьбе с вызванной им пандемией, нет. Значит дело не в ВИЧ, а в том процессе, индикатором которого он является. Так с чем же тогда в действительности мы столкнулись в эту пандемию? Геном человека. Рассматривать ВИЧ как самостоятельное явление природы можно было в 1980-х г., но никак не сегодня, когда уже расшифрован геном человека. Результаты этой грандиозной работы стали неожиданностью для самих генетиков. Нечто подобное ждали, но что бы оказалось так как оказалось, никто из известных в 1990-х гг. генетиков и не помышлял. Почти половину генома человека составляют различные транспозируемые элементы и только один процент — это кодирующие последовательности, экзоны, на изучении которых строилась вся генетика человека в ХХ столетии. Суммарные данные о содержании разных видов последовательностей в геноме человека приведены в табл. 1. Таблица 1 Нуклеотидные последовательности, входящие в состав генома человека*
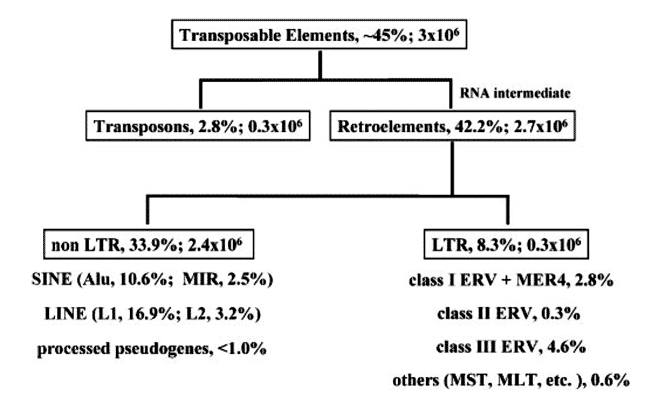
* Из книги Тарантул В.Э., 2003 Транспозируемые элементы делятся на два основных класса: ДНК транспозоны и ретроэлементы, последние составляют до 42 % от генома человека и мало чем отличаются от ВИЧ. Но их отличия мы рассмотрим позже, а пока только то, что их сближает. Ретроэлементы кодируют обратную транскриптазу и, как и ВИЧ, перемещаются по геному человека через образование РНК-транскрипта. Образовавшийся транскрипт транскрибируется «обратно» в ДНК-транскрипт и встраивается в хромосому клетки. При перемещении ретротранспозонов соблюдается принцип — «копировался и вставился» («copy and paste»), как в «доброе старое время» протоклеточных образований архейской эры (Супотницкий М.В., 2006). Классификация транспозируемых элементов, их процентное содержание и приблизительное количество показаны на рис. 1.
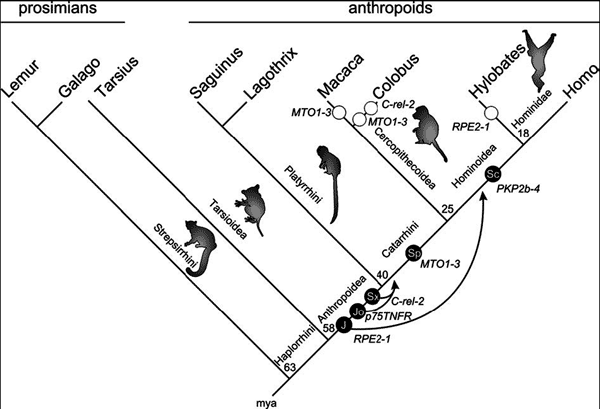
Рис. 1. Классификация транспозируемых элементов генома человека (по Bannert N., Kurth R., 2004) По этим данным получается, что структуры подобные провирусу ВИЧ, обобщенно называемые ретроэлементами, и есть геном человека. Следовательно, они первичны, а человек и другие организмы начиная с PROTOZOA, по отношению к ним вторичны. И прежде чем мы рассмотрим эволюционный аспект этой проблемы, давайте посмотрим на то, что же такое время для нас и для них. Время. Нам нужно ясно понимать то, что ретроэлементы генома клетки, вирусы, бактерии и одноклеточные организмы бессмертны, так как они либо копируются с матрицы, либо размножаются делением. В отличие от нас они не знают смерти, как разделения пространства и времени. Процессы, в которых они участвуют, идут вне нашего ощущения времени (год, месяц, неделя, час, минута и т. п. — этого измерения для них не существует) и вне зависимости от продолжительности существования отдельных видов живых существ, всегда являющихся для ретровирусов и ретроэлементов генома промежуточными хозяевами. Поэтому не смысла обманывать себя терминами, отражающими наше понимание времени, когда речь идет о процессах, в которых участвуют ретроэлементы и ретровирусы. И с этой точки зрения целесообразно смотреть на эволюционные процессы, в которых они участвуют (Супотницкий М.В., 2000). Ретровирусы и ретроэлементы человека в эволюционном аспекте . Обнаруженные в геноме современного человека L1 ретротранспозоны имеют свою собственную эволюционную историю, начавшуюся еще с мезозойской эры (по нашему летоисчислению — это не менее 100 млн лет); т. е. в известном нам виде они существовали еще до появления класса млекопитающих (Furano A. V., 2000). Эффективно дуплицируя сами себя, L1 играют ключевую роль в увеличении генома вида посредством размножения нетранспозируемых Alu- и SVA-элементов, и образования ретропсевдогенов. Приведу только один пример участия L1 ретротранспозонов в эволюции человека — образование секретируемых форм человеческого трансмембранного белка аттрактина. L1 обеспечил преждевременный стоп-кодон и полиаденилационный сайт, ответственные за синтез усеченного растворимого аттрактина. Обе формы, трансмембранный и растворимый белки, вовлекаются в клеточные взаимодействия при воспалительном процессе. В данном конкретном случае вставки L1 ретроэлементов создали для вида Homo sapiens более тонкие механизмы регуляции воспалительных ответов (Tang W. et al., 2000). Среди других семейств ретроэлементов, Alu наиболее многочисленны в геноме человека. Они представлены более чем 1,4 млн копий, которые соответствуют 10 % всей массы генома. Их число продолжает расти, и они встраиваются во все новые сайты с частотой примерно одно новое встраивание на 100–200 новорожденных (Аст Г., 2005 ) . Происхождение первых Alu-мономеров, называемых также «окаменелыми» Alu-мономерами (fossil Alu monomers, FAMs), неизвестно, и их история уходит в глубину геологического времени. «Современные» Alu–элементы генома человека появились не ранее чем 55 млн лет назад, фактически в эпоху «до приматов-антропоидов». Вставки Alu-экзонов вводят преждевременные терминальные кодоны или рамки считывания, а сами Alu-элементы генома человека действуют как очень большой резервуар альтернативных экзонов. Вот любопытный пример того, в каких временных интервалах в нашем восприятии времени, идут эволюционные процессы с участием этого ретроэлемента. Singer S. et al. (2004) реконструировали последовательность событий, приведших к образованию альтернативного 5 '-экзона гена рецептора фактора некроза человека (p75TNFR). По крайней мере, пять мутационных событий, произошедших в течение 63 млн лет, оказались необходимыми для случайной экзонизации и фиксации гена p75TNFR в нашем геноме: 1) интеграция с геномом примата Alu-элемента; 2) приобретение альтернативного сайта начала транскрипции; 3) образование альтернативного стартового кодона; 4) формирование сайта сплайсинга; 5) и только после этого случайно появилась делеция семи нуклеотидов, приведшая к образованию открытой рамки считывания. Каждое такое событие отделяют миллионы лет и исчезнувшие виды приматов, оставшиеся неизвестными палеоантропологам. На рис. 2 суммированы результаты M. Krull et al. (2005), полученные ими при оценке возраста четырех генов и ранее описанного Singer et al. (2004) гена p75TNFR.
Рис. 2. Оценка возраста интеграционных актов пяти исследованных Alu-элементов и их аффинации в субклассы Интеграционные акты показаны в виде черных кружков с белыми надписями, указывающими субсемейства Alu. Стрелками показано спроецированное время экзонизации в миллионах лет после интеграции Alu. Вероятное полное аннулирование экзонизации этих же генов для Cercopithecoidea и Hylobates показано открытыми кольцами. Феномен аннулирования экзонизации уже сам по себе свидетельствует не только о возможности «прогрессивной эволюции» под воздействием процессов, в которых участвуют ретроэлементы, но и, наоборот, о возможности регресса вида и его замещения более примитивными эволюционными ветвями. Ген RPE2-1 (ribulose-5-phosphate-3-epimerase transcript variant 2) — у людей найден в пределах хромосомы 2q32-q33.3. Ген C-rel-2 (изоформа C-rel прото-онкогенного протеина) — у людей расположен в хромосоме 2p13-p12. Ген MTO1 (mitochondrial translation optimization gene homolog) — у людей расположен в хромосоме 6q13. Ген PKP2 (plakophilin) — у людей расположен в хромосоме 12p11. Таким образом, давление естественного отбора закрепило за эндогенными ретротроэлементами функцию постепенного наращивания генома вида-хозяина путем образования новых собственных копий; его усложнения путем образования новых экзонов из интронов и/или увеличения количества генов, подвергающихся альтернативному сплайсингу. Они придают виду способность к многовариантности эволюционных ответов на изменения в окружающей среде. Благодаря избыточности создаваемого эндогенными ретротроэлементами генетического материала, под давлением естественного отбора происходит усложнение вида (анагенез); и/или его «расщепление» на дочерние виды (кладогенез). Исходные виды, ставшие в изменившихся условиях среды неадаптивными, вымирают. Еще более интересные результаты дают исследования участия в эволюции человека эндогеных ретровирусов человека (human endogenous retroviruses, HERVs) . По данным, обобщенным В. Г. Галактионовым (2004, 2005), прародителем V-генов суперсемейства иммуноглобулинов (вариабельные области L- и H-цепей иммуноглобулинов — от их взаимодействия между собой зависит специфичность иммуноглобулинов как антител) был ген белка Thy-1. Он существует уже не менее 2 млрд лет и у первых многоклеточных выступал как один из поверхностных молекулярных факторов специфической межклеточной адгезии. Но должно было произойти другое важное эволюционное событие, чтобы возникло основное свойство классических иммуноглобулинов — взаимодействие с чужеродным антигеном. Ждать его пришлось всего 1,5 млрд лет. Главным «виновником» формирования специфических иммуноглобулинов оказался ретровирус, который внедрился в единый V-ген предков позвоночных животных около 450 млн лет назад. Это событие привело к расщеплению V-гена на собственно V-ген и D- и J-сегменты. Геномные участки, оказавшись самостоятельными, подвергались обычным генетическим процессам — в первую очередь тандемным дупликациям и случайным мутациям. Интродуцировавшиеся в геном позвоночных ретровирусные гены рекомбиназ RAG-1 и RAG-2 резко ускорили процесс реорганизации V-, D-, J-генных сегментов. Эти ферменты являются ключевыми участниками V(D)J-рекомбинации (RAG-1 в условиях in vitro способна функционировать еще и как транспозаза)! Случайность объединения V-, D-, J-генных сегментов определила множественность синтезируемых V-доменов и возможность дальнейшей эволюции специфического иммунитета. В результате возникло множество V-генов (у млекопитающих в настоящее время их более 500). Не случись этой интеграции ретровируса в единый когда-то V-ген, эволюция многоклеточных не пошла бы по тому сценарию, который позволяет нам теперь выяснять ее подробности (более подробно о процессах, лежащих в основе эволюции иммунной системы см. в выше цитированных работах В. Г. Галактионова). Всего же у людей, по данным J. Klein и H. Nicjladis (2005), иммунную систему на основе антител «обслуживают» до 5% транскрибируемого и транслируемого генома. Интересно, о какой тогда ВИЧ-вакцине рассуждают некоторые академики РАМН, если иммунная система позвоночных создавалась ретровирусами сотни миллионов лет для своего собственного размножения? Однако обратимся к «современным» эндогенным ретровирусам (прилагательное «современный» мы здесь употребляем в смысле наличия этих ретровирусов в геноме современного человека). Их идентифицировано уже более 50. Они сохранили структуру, сходную с экзогенными ретровирусами типа ВИЧ, за исключением того, что очень немногие содержат открытые рамки считывания для генов трех основных структурных белков Gag, Pol и Env . Все из этих наиболее полных провирусов принадлежат к их молодому семейству HERV-K, которое исключительно поддерживается в геноме приматов Старого света (Old World monkeys, OWMs), включая человекообразных обезьян и людей (Greenwood A. D. et al., 2005). Происхождение многих эндогенных ретровирусов человека уходит в глубину эволюционной истории приматов примерно на 30-45 млн лет (см. работы Sverdlov E. D., 2000; и Hughes J . F., Coffin J. M., 2005). В действительности они должны быть намного древнее, так как некоторые ретроэлементы геномов приматов Старого Света имеют возраст не менее 55 млн лет (Bannert N., Kurth R . 2004). Ретровирусы семейства HERV-K были активны перед и после эволюционного разделения человека и шимпанзе 5—6 млн лет назад. Некоторые из них встречаются исключительно только у людей, тем самым показывая, что они интегрировались с его геномом уже после разделения этих линий (табл. 2). Таблица 2 Видовое распределение и время интеграции HERV - K элементов в геном человека *
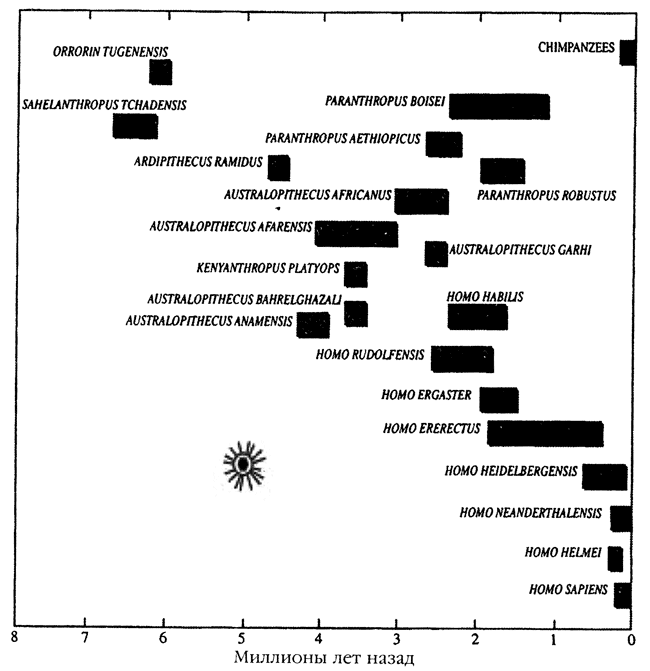
* По J . F . Hughes и J. M. Coffin (2005); недавно в геноме человека было идентифицировано новое семейство эндогенных ретровирусов — см. работу N. Polavarapu et al. (2006). ** OWM – обезьяны Старого Света (Оld World monkeys). Теперь мы подходим к самому интересному результату совместной эволюции приматов и ретровирусов. По данным P. Jern et al. (2006), в эволюции шимпанзе и людей участвовали разные эндогенные вирусы и с разными сценариями активности. Авторы нашли различия в недавней (т. е. имевшей место в ближайшие 5 млн. лет) активности бета-подобных и гамма-подобных эндогенных ретровирусов в геномах этих видов приматов. Сама же гамма-ретровирусная интеграционная активность была разделена во времени от бета-ретровирусной. На этот же период времени приходится разделение сценариев активности других ретроэлементов современных приматов — Alu-элементов (Hedges D. J. et al., 2004). Давайте запомним эту цифру — 5 млн лет. Ниже мы сопоставим ее с находками палеоантропологов, относящихся к этому времени, и нам будет о чем подумать. Сравнение генома людей и близкородственных приматов, показало, что различия между ними являются следствием не столько вариаций в их генах, сколько результатом различий в экспрессии и регуляции одних и тех же генов. Например, исследования, основанные на микроанализе ДНК, показывают, что экспрессия сложных генов человеческого мозга значительно превышает их же экспрессию у нечеловекообразных приматов. Но ткани, иные чем мозг, у этих же приматов не показывают значительных различий в экспрессии генов. В этой связи любопытны эксперименты А. Stengel et al. (2006), обнаруживших повышенную экспрессию HERV в тканях мозга человека, но оказывавшихся либо полностью неактивными в аналогичных тканях обезьян Старого Света, либо их экспрессия была незначительной. Теперь сопоставим эти данные с более ранними наблюдениями палеоантропологов эволюции мозга человекообразных приматов, обобщенных в работе С. Оппенгеймера (2004). Его собственные объяснения эволюции человека сводятся к необходимости приспособления приматов к внешним факторам, среди которых он на первое место ставит похолодание климата Земли, начавшееся 7-8 млн лет назад. И в качестве адаптивного признака к холоду антрополог Оппенгеймер почему-то видит увеличение объема мозга человекообразных приматов, а не увеличение длины их шерсти. По данным антропологических исследований, примерно 7-8 млн лет назад произошло резкое сокращение числа видов человекообразных приматов, совпавшее по времени с расширением площади безлесых травяных степей и глобальным похолоданием, продолжавшимся несколько миллионов лет. Но именно в этот период произошла дивергенция какого-то неизвестного вида приматов на виды, в последующем дивергировавшие на гоминоидов (наших ближайших предков), горилл, орангутангов, бабуинов и шимпанзе (рис. 3).
Рис. 3. «Взрывная» дивергенция видов гоминоидов . Произошла 5-2 млн лет назад после процессов эндогенизации ретровирусов, наиболее представленных в нашем геноме в настоящее время. «Звездочкой» обозначена массовая ретровирусная эпизоотия, ее «следы» сегодня обнаруживаются в геноме приматов в качестве эндогенных ретровирусов (за основу взята схема Оппенгеймера С., 2004). «Списать» оба эти процесса только на «похолодание» не удается, так как тогда же вспыхнули массовые эпизоотии ретровирусных инфекций, оставивших в качестве «отпечатков» в геноме этих видов не менее семи типов эндогенных ретровирусов. Эпизоотии были настолько масштабными, что почти не сохранили в геноме выживших видов приматов «следов» других подобных эпизоотий за предшествующие несколько миллионов лет (см. табл. 2). Любопытно и то, что с этого периода времени у предков шимпанзе и предков человека функционируют разные эндогенные ретровирусы и Alu-элементы с разными сценариями активности (см. выше данные Jern P. et al., 2006). С этого же времени у крупных травоядных обезьян за весь период сравнения (5 млн лет) не было выявлено никаких признаков увеличения объема мозга, тогда как у гоминоидов обеих ветвей Homo (ergaster и babilis) и Parantbropus (boisei) такие изменения произошли. В этот период появилось не только несколько новых видов Homo и Parantbropus со значительно большим объемом мозга, но и, что весьма показательно, объем мозга увеличился у всех гоминоидов в пределах каждого вида с 400 до 900 см 3 (Elton S. et al., 2001). С. Оппенгеймер (2004) отмечает прерывистость увеличения объема мозга при переходе от древних гоминоидов к современному человеку. Он приводит следующий пример. Увеличение объема мозга между древнейшим Homo babilis, жившим примерно 2 млн лет назад; и Homo rbodesiense, жившим 1,07-1,3 млн лет назад, т. е. в период 700 тыс. лет, составило более чем в 2,5 раза. В последующие же 1,2 млн лет, несмотря на тот факт, что гоминоидам было присуще некоторое увеличение объема мозга, от достижения объема мозга современного человека их отделяло всего 6 %. Фактически же за последние 150 тыс. лет у человека современного типа имело место снижение объема мозга. Оппенгеймер, привязавший свою теорию эволюции гоминоидов к похолоданиям климата, не смог скрыть своего удивления, когда не нашел очередных скачков роста объема их мозга в ледниковые периоды последнего миллиона лет и, в частности, ледникового периода, закончившегося 30 тыс. лет назад. Но и в геноме человека не находят следов масштабных ретровирусных атак, пришедшихся на последний ледниковый период (см. табл. 2). А теперь мысленно переместимся в глубь времени в нашем его восприятии и сопоставим другие ретровирусные атаки с дивергенцией приматов (рис. 4).
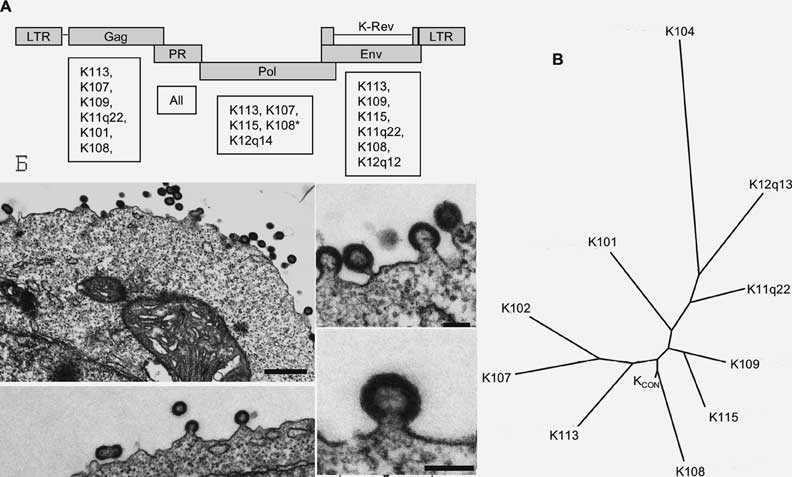
Рис. 4. Дивергенция видов приматов. Показано распределение эндогенных ретровирусов, интегрировавшегося с геномом передкового вида современных приматов в период от 30 до 5 млн лет назад. «Звездочками» указаны периоды ретровирусных эпизоотий, следы которых обнаруживаются в геноме современных приматов (см. табл. 2). Числа в перевернутых треугольниках показывает ориентировочное время (в млн лет) расхождения отдельных эволюционных ветвей приматов (за основу взята схема Coffin J. M., 2004). Получается, что толчком к дивергенции приматов становились эпизоотии ретровирусных инфекций, заканчивающиеся эндогенизацией вызвавших их ретровирусов. Правда J. M. Coffin (2004), нарисовавший большую часть этой схемы, представляет дивергенцию приматов бесхитростно, как некое прогрессивное явление, имеющее своей целью создание именно тех их видов, во главе которых сегодня как венец творения Природы стоит человек, на чем этот процесс, разумеется, заканчивается, и раскрутившийся «маховик эволюции» достигнув вида Homo sapiens, вдруг останавливается. Но так не бывает! Если придерживаться распространенной точки зрения на эндогенизацию ретровирусов как на процесс «перехода» экзогенного ретровируса, вызывающего эпидемии среди своих новых хозяев (а для наших отдаленных предков правильнее использовать термин «эпизоотии»), в эндогенный вирус-мутант, не способный образовывать вирусные частицы и передаваться горизонтально, то надо предполагать еще и ту цену, которую заплатил отряд приматов за эту «интеграцию». Такая «эндогенизация ретровируса» неизбежно должна сопровождаться массовым вымиранием их отдельных видов и, даже, семейств. Учитывая особенности этих инфекционных процессов , «эндогенизация» в нашем восприятии времени длилась десятки тысяч лет (см. Supotnitskii M. V., 1995; Супотницкий М.В., 2000; 2006). Обычно палеоантропологи теряются в догадках о причинах вымирания видов без вроде бы должных на то оснований (а это у них не менее чем изменения климата, тектонические и космические катастрофы и т. п.; других себе они не представляют — см. работу Оппенгеймера С., 2004). Массовая гибель приматов после каждой ретровирусной атаки снижала заполненность занимаемых ими экологических ниш и способствовала увеличению темпов видообразования у тех представителей их отряда, которые «прошли» через процесс эндогенизации новых ретровирусов. В плане сравнения, интересно посмотреть на тех приматов, которые в своей эволюционной истории не сталкивались с ретровирусными атаками. К счастью раскол континента Гондваны, произошедший почти 35-40 млн лет назад, предоставил нам эту возможность. Известно, что обезьяны Нового Света (New World monkeys, NWMs) обычно либо вообще не имеют, либо имеют только сильно редуцированные копии эндогенных ретровирусов большинства классов (Greenwood A. D. et al., 2005). Объяснение причин отсутствия следов «ретровирусных атак» в геноме обезьян Нового Света представляет собой не менее интересную задачу, чем объяснение их наличия для обезьян Старого Света. Получается, что существуют либо неизвестные источники ретровирусов для приматов (и с ними не соприкасались приматы Американского континента — в качестве таких источников мы предполагаем почвенных амеб; см. Супотницкий М.В., 2006), либо в природе имеются какие-то терминаторы ретровирусных эпизоотий, которые не представлены в Старом Свете. А вот результат эволюции без «эндогенизации» ретровирусов, как говорится, «на лицо». Обычно обезьян Нового Света относят к надсемейству примитивных широконосых обезьян. Это мелкие обезьяны с широкой хрящевой носовой перегородкой, с направленными вперед ноздрями, когтеобразными ногтями и хватательным хвостом. Большой палец не противопоставляется другим, полушария мозга гладкие. Свою цену за эволюцию они явно не заплатили. Заканчивая рассмотрение роли эндогенных ретровирусов человека в его эволюции, важно отметить тот факт, что процесс эндогенизации ретровирусов в ограниченных масштабах с пока не обнаружившимися эволюционными последствиями, имел место уже после его формирования как вида Homo sapiens (т.е. приблизительно 170 тыс. лет назад — оценка Оппенгеймера С., 2004). Например, возраст обнаруженного G. Turner et al. (2001) провируса HERV-K113 не превышает 100 тыс. лет. Он локализован в хромосоме 19 (19p13.11) и пока не полностью зафиксирован в человеческих популяциях. Генотипирование генетически различных популяций показало, что его аллельная частота зависит от исследуемой этнической группы. Провирус весьма распространен среди людей, живущих в Африке, Азии и Полинезии. С точки зрения масштабов времени, в которых происходят эволюционные процессы у приматов, его «возраст» незначителен. Выше мы уже привели данные, показывающие, что для эволюции современного гена p75TNFR человека потребовалось 65 млн лет, пять мутационных событий и неизвестное количество вымерших видов приматов-предшественников, в геноме которых эти события и происходили. Основываясь на данных G. Turner et al. (2001), N. Bannert N. и R. Kurth (2004) предположили, что полностью интактные и активные аллели HERV все же либо представлены в популяциях людей с очень низкой частотой, либо встречаются с высокой частотой, но в генетически разделенных этнических группах. Сами же G. Turner et al. (2001) полагают, что их находка показывает способность HERV-K реинфицировать популяции людей в недавнем эволюционном прошлом, и что HERV-K113 реинфицирует людей даже сегодня. Следовательно, возможна не только эндогенизация ретровирусов, но и их экзогенизация и реинфекция. По этому аспекту проблемы есть весьма интересные наблюдения, которые мы рассмотрим ниже. Таким образом, роль в эволюции экзогенных ретровирусов, не способных к эндогенизации, заключается в увеличении биологического разнообразия через терминацию эволюции неадаптивных видов. Увеличение темпов видообразования происходит уже после массовых вымираний таких видов и снижения степени заполненности ими экологических ниш. Ретровирусное инфицирование вида, сопровождающееся эндогенизацией вируса, возможно не при всех сценариях его существования, однако если оно произошло, то влечет за собой труднопрогнозируемые эволюционные последствия на протяжении нескольких миллионов лет. У людей эволюционные процессы с участием HERV, еще до дивергенции приматов на предков шимпанзе и предков человека, создали определенный генетический «задел на будущее», предопределяя альтернативы нашей дальнейшей эволюции. Реинфекция. Количество копий эндогенных ретровирусов в пределах зародышевой линии без их репликации, может увеличиваться по двум альтернативным механизмам: 1) ретротранспозицией в cis — когда вирусы используют свои собственные гены белков для мобилизации; они копируют сами себя и вставляются в новые участки хромосомы в пределах той же клетки, без обычной для ретровирусов экстрацеллюлярной фазы жизненного цикла; 2) через комплементацию в trans , когда белки, необходимые для пролиферации вирусов, добавляются другими эндогенными и экзогенными вирусами. Ретротранспозиция в cis не требует интактного гена env (он необходим вирусу для перемещения за пределы клетки); комплементация в trans не нуждается в наличии у эндогенного ретровируса функционирующих генов. Достаточно что бы он имел промотор и другие «мотивы» для экспрессии и упаковки РНК. Пролиферация эндогенных ретровирусов посредством таких механизмов приводит к накоплению в их геноме большого количества мутаций и стоп-кодонов (Belshaw R. et al., 2004). Эти изменения почти не затронули эндогенный ретровирус HERV-K(HML-2), обнаруженный в геноме приматов Старого Света. «Возраст» вируса оценивается в 6 млн лет (см. рис. 2). Но не только у приматов Нового Света находят «пустые» сайты интеграции этих ретровирусов, но и в геноме многих людей (Belshaw R. et al., 2005), что показывает их сравнительно недавнее участие эволюции человека. HERV-K(HML-2) содержат неповрежденные открытые рамки считывания почти во всех генах, включая env . У них низкое соотношение несинонимичных и синонимичных замен (dN/dS). Эти находки указывают на постоянную селекцию именно интактных генов белков HERV-K(HML-2), необходимых для экстрацеллюлярной фазы жизненного цикла ретровируса, а не дефектных; и на то, что HERV-K(HML-2) увеличивали количество своих копий в геноме человека преимущественно через реинфекцию, а не через ретротранспозицию в cis или комплементацию в trans . Y. N. Lee et al. (2007) попытались воспроизвести инфекционный провирус HERV-K(HML-2). Для определения способности структурных белков и ферментов, закодированных в геноме HERV-K, «собирать» ретровирус-подобные частицы, ими были сконструированы плазмиды, экспрессирующие Gag, Gag - PR и Gag - PR - Pol . Геном HERV-K имеет необычный нуклеотидный состав, в котором много кодонов, кодирующих аденин (A-rich). Не случайным является то, что такая особенность генома HERV-K характерна и для ВИЧ-1. Первоначально Y. N. Lee et al. (2007) для получения инфекционного ретровируса был использован HERV-K-К113, имеющий интактные открытые рамки считывания для вирусных белков (за исключением одного гена) и считающийся сегодня самым «молодым» среди эндогенных ретровирусов HML-2 (см. выше). Однако плазмиды, сконструированные на основе генов этого провируса, плохо их экспрессировали в культурах клеток и вирусные частицы не образовывались. Тогда исследователи пришли к выводу, что относительная «молодость» эндогенного ретровируса еще не гарантирует экспрессии всех его генов. Они отобрали группу из 10 вирусов, имевших дефекты, по крайней мере, в одном структурном гене, и установили консенсусные последовательности каждого гена. Синтезированный вирус с такой последовательностью нуклеотидов они назвали HERV-KCON . На построенном филогенетическом древе HERV-KCON занимает место, соответствующее предковой последовательности HERV-K, интегрировавшегося с геномом гоминид 6 млн лет назад (рис. 5) .
Рис. 5. Синтезированный вирус HERV - KCON Схематическое изображение провируса HERV-K (А) и филогенетического древа этого семейства (Б). Электронная микрофотография ретровирусных частиц HERV-KCON , образовавшихся в культуре клеток 293Т (В). Открытые рамки считывания изображены прямоугольниками. Под ними приведен список ретровирусов, чьи нуклеотидные последовательности были использованы для установления консенсусных последовательностей структурных генов HERV-KCON. Сборка вирусных частиц происходит также как и у ВИЧ, на плазматической мембране клетки (Lee Y. N. et al., 2007). Эксперименты Y .N. Lee et al. (2007) показали, что геном HERV-KCON содержит все функциональные компоненты, необходимые для осуществления им полного цикла ретровирусной репликации. В дальнейших экспериментах исследователями установлено, что HERV-KCON оказался способен образовать псевдотипные частицы с ВИЧ-1 и вызывать их проникновение в линии клеток человека. На основе анализа генома эндогенных ретровирусов HERV-K (HML-2) и собственных экспериментальных данных, Y. N. Lee et al. (2007) сделали вывод о существовании пока неизвестных механизмов активации эндогенных ретровирусов, . Они предположили возможность существования штаммов HERV-K в еще не идентифицированных репликационно-активных формах у отдельных людей и/или в их изолированных популяциях, что говорит за то, что современные пандемии ретровирусных инфекций среди людей не ограничиваются только ВИЧ. Однако темпы и эволюционное значение для вида Homo sapiens пандемий, вызываемых HERV-K и ВИЧ, скорее всего, различаются. Пока мы не знаем, с какой частотой происходила эндогенизация ретровирусов HERV-K (HML-2) в геноме древних гоминоидов и человека, и не можем предполагать ни такую возможность для ВИЧ, ни темпы этого процесса в нашем ощущении времени. С учетом того, что интеграционные сайты для ВИЧ обнаружены в основном в активных транскрипционных участках (см. работу Lewinski M. K et al., 2006), его эндогенизация обещает «возвращение назад», т. е. регресс вида через анулирование экзонизации. Для пытливых исследователей в этом аспекте геномных исследований содержится масса задач для творчества и возможность сделать фундаментальные научные открытия. Коинфекция . Экзогенные и эндогенные ретровирусы взаимодействуют между собой в инфицированных клетках, но этот процесс еще плохо изучен. Например, по данным Contreras - Galindo R . et al . (2007), у ВИЧ-инфицированных больных раком появляются антитела к антигенам HERV-K, а экспрессия белков HERV-K приводит к цитотоксическим ответам Т-клеток. Эти же авторы в экспериментах в условиях in vitro показали, что ВИЧ-1 увеличивает экспрессию РНК HERV-K дозозависимым образом, и что экспрессия HERV-K в CD 4(+) в Т-клетках ВИЧ-инфицированных пациентов выше, чем в контроле. ЗаключениеЭукариотические виды существуют, эволюционируют и исчезают в тесном ретровирусном «объятии». Пандемии ретровирусных инфекций представляют собой «слоеный пирог». Его самый «верхний слой» составляют ретровирусы, активно размножающиеся в цитоплазме клеток хозяина; самый «нижний» представлен репликационно-активными формами эндогенных ретровирусов. «Слои» «переложены» экзонами и интронами генов, ретротранспозируемыми и регуляторными элементами, псевдогенами и др. последовательностями генома хозяина. Раскрытие взаимоотношений между ними, скорее всего, составит основное содержание генетики на ближайшие десятилетия. Наше собственное место в природе, особенно в сравнении с тем, которое занимают ретровирусы, очень невелико. ВИЧ/СПИД-пандемия не является отдельной самостоятельной пандемией, вызванной проникновением в человеческие популяции нового вируса. Она «верхушка» более сложного природного явления — эволюционного процесса, который представляется нам в маске инфекционного. В эволюции гоминоидов ВИЧ и подобные ему ретровирусы играют роль фактора естественного отбора, ускоряющего процессы, определяемые в их геноме активностью HERV-K (HML-2) и других эндогенных ретроэлементов. Пандемия ВИЧ/СПИДа — это терминация неадаптивного вида, она имеет критическое значение для нашего существования как биологического вида. И надо было быть слишком нелюбопытным, что бы за 25 лет пандемии ВИЧ/СПИДа «не заметить», что это совершенно иной процесс, чем пандемии гриппа, натуральной оспы или чумы. Словарь терминовАнагенез — тип эволюционного процесса, близкий к прогрессу. Для него характерны возникновение нового типа организации и расцвет группы. Характеризуется усложнением органов, совершенствованием их деятельности и автономизацией развития. dN/dS-соотношение — соотношение несинонимических замен (dN) к синонимическим заменам (dS). Используется для выявления филогенетических различий между геномами (их филогенетическими ветвями), сравниваемых по нуклеотидным последовательностям. Мутации, которые ведут к несинонимичным аминокислотным заменам, наиболее вероятно нарушают функции белковой молекулы, чем мутация, приводящая к синонимичной замене (привести примеры). Соотношение dN/dS меньше 1 показывает, что в отношении данного признака имела место очищающая селекция (purifying selection); больше 1, то имела место позитивная селекция; и обратно, если селекции не было (нейтральная эволюция), то соотношение должно быть равным 1. Дивергенция — расхождение признаков организмов в ходе эволюции. Естественный отбор — преимущественное выживание особей, более приспособленных к конкретным условиям среды, что приводит к изменению выраженности тех или иных признаков в ряду поколений популяции; основной фактор эволюции живой природы. Интрон — часть гена, переписывающаяся в РНК, но затем из нее удаляемая ферментативным путем при образовании зрелой мРНК; эта часть не кодирует белок. Кладогенез (син. истинное видообразование, дихопатрическое видообразование) — форма эволюции группы живых организмов, приводящая посредством дивергенции к увеличению числа отграниченных друг от друга видов, родов, семейств. Обратная транскриптаза — фермент, осуществляющий ДНК-зависимый синтез ДНК и синтез ДНК на матрице РНК (обратная транскрипция); кроме того, фермент обладает активностью РНКазы Н (т.е. разрушает цепь РНК, входящую в состав ДНК/РНК-дуплекса). Синтезирует двуцепочечную ДНК на матрице геномной РНК ретровирусов, подготавливая ее для интеграции в геном клетки-хозяина. Обратная транскрипция — комплементарный синтез ДНК на матрице РНК при участии обратной транскриптазы. Прокариоты (доядерные) — организмы, не обладающие типичным клеточным ядром и хромосомным аппаратом. К ним относят бактерии, риккетсии, микоплазмы и др. Ретровирусы — РНК-содержащие вирусы, имеющие в своем составе фермент обратную транскриптазу, копирующий РНК в ДНК, интегрирующуюся затем с геномом организма-хозяина. Ретротраспозоны — транспозоны, механизм транспозиции (перестановки по геному) которых полностью совпадает с частью жизненного цикла ретровируса, однако они лишены функциональной белковой оболочки и могут перемещаться лишь внутри какой-нибудь одной клетки и быть переданы ее потомкам. Сплайсинг — процесс «сшивки» молекул мРНК кодирующих участков (экзонов) после вырезания из первичного транскрипта (предшественника мРНК, пре-мРНК) последовательностей, не несущих никакой информации (интронов). Сплайсинг альтернативный — соединение экзонов данного гена в разных комбинациях с образованием различающихся зрелых молекул мРНК. Сплайсинга сайт — каноническая последовательность динуклеотидов на границе экзон-интронных областей; необходима для правильного сплайсинга. Транспозаза — фермент, участвующий в транспозиции (перемещении из одного сайта в другой) некоторых мобильных генетических элементов. Эволюция: 1) в биол. преобразование формы и образа жизни организмов, в результате чего потомки приобретают другие черты, отличающие их от предков; 2) в широком смысле — синоним развития; в более узком смысле — один из основных типов развития: медленные, постепенные количественные и качественные изменения, в отличие от революции. При этом каждое новое состояние объекта имеет по сравнению с предшествующим более высокий уровень организации и дифференциации функций. Экзон — часть гена, кодирующая участок структуры его продукта (белка, РНК) в ходе экспрессии гена экзоны образуют зрелую информационную РНК. Экзонизация — процесс, посредством которого ген может приобрести новый альтернативный сайт сплайсинга. Обычно это происходит в результате мутации в уже существующей интронной последовательности гена, которая приводит к ее превращению в кодирующий регион мРНК, т.е. в экзон. Эукариоты — организмы, у которых: 1) имеется ядро, где содержатся хромосомы; 2) в цитоплазме присутствуют различные органеллы — митохондрии, хлоропласты и т. д. К ним относятся животные, растения, грибы, некоторые водоросли. Список литературыАст Г. Альтернативный геном // В мире науки. — 2005. — № 7. — С. 37–43. Галактионов В.Г. Происхождение специфических иммуноглобулинов // Природа. — 2004, — № 7. — C. 40-46. Галактионов В.Г. Эволюционная иммунология. — М., 2005. Оппенгеймер С. Изгнание из Эдема. Хроника демографического взрыва. — М., 2004. Супотницкий М.В. Микроорганизмы, токсины и эпидемии. — М., 2000, 2005. Супотницкий М.В. К вопросу о месте ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов // Эпидемия ВИЧ/СПИД в Украине. — 2006. — № 2. — С. 163–196. Тарантул В.З. Геном человека. Энциклопедия, написанная четырьмя буквами. — М., 2003. Bannert N., Kurth R. Retroelements and the human genome: New perspectives on an old relation // Proc. Natl. Acad. Sci. USA. — 2004. Vol. 101, Suppl. 2. — P. 14572–14579. Belshaw R., Dawson A.L., Woolven-Allen J. et al. Genomewide screening reveals high levels of insertional polymorphism in the human endogenous retrovirus family HERV-K(HML2): Implications for present-day activity // J. Virol. — 2005. — Vol. 79. — P. 12507—12514. Contreras-Galindo R., Contreras-Galindo A., Lorenzo E. et al. Evidence for replication of human endogenous retroviruses type K (HERV-K) in HIV-I positive patients // Retrovirology. — 2006. — Vol. 3 (Supl. I), S33. Contreras-Galindo R., Lopes P., Veles R. et al. HIV-1 infection increases expression of human endogenous retroviruses type K (HERV-K) in vitro // AIDS Res. Hum. Retroviruses. — 2007 . — Vol. 23, № 1. — Р . 116—122. Elton S. et al. // Journal of Human Evolution. — 2001. — Vol. 41. — P. 1—27. Furano A.V. The biological properties and evolutionary dynamics of mammalian LINE-1 retrotransposons // Prog. Nucleic Acids Res. Mol. Biol. 2000. — Vol. 64. — P. 255–294. Greenwood A. D., Stengel A., Erfle V. et al. The distribution of pol containing human endogenous retroviruses in non-human primates // Virology. — 2005. — Vol. 334. — P. 203–213. Krull M., Brosius J., Schmitz J. Alu-SINE Exonization: En Route to Protein-Coding Function // Mol. Biol. Evol. — 2005. — Vol. 22, — № 8. – P. 1702–1711. Lee Y.N., Bieniasz P. Reconstitution of an Infectious Human Endogenous Retrovirus // PLoS Pathogens. — 2007. — Vol. 3, № 1. — P. 0119—0130. Lewinski M.K, Yamashita M., Emerman M. et al. Retroviral DNA integration: Viral and cellular determinants of target-site selection // PloS Pathog. — 2006. — Vol. 2, № 6. — P. 611—620. Polavarapu N., Bowen N., McDonald J. Newly Identified Families of Human Endogenous Retroviruses // Journal of Virolology. — 2006. — Vol. 80, № 9. — P. 4640–4642. Singer S. S., Maennel D. N., Hehlgans T. et al. From ‘‘junk'' to gene: curriculum vitae of a primate receptor isoform gene // J. Mol. Biol. — 2004. —Vol. 341. — P. 883–886. Stengel A., Roos C., Hunsmann G. et al. Expression Profiles of Endogenous Retroviruses in Old World Monkeys // Journal of Virolology. — 2006. — Vol. 80, № 9. — P. 4415—4421. Supotnitskii M. V. After AIDS // Mendeleev Chemistry Journal. —1995. — Vol. 40, № 2. — P. 189–208. Sverdlov E. D. Retroviruses and primate evolution // Bioessays. — 2000. — Vol. 22. — P. 161-171. Tang W., Gunn T. M., McLaughlin D. F. et al. // Proc. Natl. Acad. Sci. USA. — 2000. – Vol. 97. — P. 6025–6030. Библиографическое описаниеСупотницкий М. В. ВИЧ/СПИД-пандемия — так с чем же в действительности мы столкнулись? // Медицинская картотека. — 2007. — № 4. — С. 24–31. Ответы на вопросы читателя в «Живом журнале» от 19.11.09 г., представившегося как 124 (http://msupotnitskii.livejournal.com/586.html?replyto=2122). 1) Каким образом (механизмами?) в широком смысле реализуется (реализовывалось?) сосуществование ретровирусов и позвоночных вообще, и человечества и ВИЧ в частности? Ретровирусы — это семейство вирусов, совершенно не похожее на те, которые в нашем представлении обычно ассоциируются с массовыми эпидемиями (натуральная оспа, грипп, геморрагические лихорадки и т. п.). Семейство представлено сложными РНК-геномными вирусами, образующими с помощью обратной транскриптазы ДНК-копию своего генома (провирус), интегрирующуюся с геномом хозяина в единую молекулу ДНК. В отличие от других РНК-вирусов, каждая ретровирусная частица содержит две РНК-цепи положительной полярности, полной длины и способные к репликации. Обычно обе цепи РНК в ретровирусной частице являются производными от одного родительского провируса. Однако если инфицированная клетка одновременно содержит два различных провируса, то их РНК-транскрипты могут сформировать отдельный гетерозиготный вирион. После проникновения в новую клетку, под действием обратной транскриптазы, заново синтезированная ретровирусная последовательность будет рекомбинантом двух родительских. Сходство с половым процессом у многоклеточных организмов здесь в том, что: 1) обе цепи РНК как две родительские гаметы сливаются в одну; 2) генетическая информация потомков будет рекомбинантной; 3) последующие «поколения» будут нести информацию обоих родителей. В природе не существует других диплоидных семейств ДНК- или РНК-вирусов. Диплоидность ретровирусов дала им существенные преимущества перед другими внутриклеточными паразитами и эндосимбионтами с РНК-геномом. Молекулы вирусной РНК реплицируются через ассиметричную транскрипцию от одной цепи, исключающую большинство корректирующих механизмов, характерных для репликации молекул ДНК. Легко возникающие при репликации РНК мутации не создают однозначных преимуществ их обладателям. Но рекомбинация между РНК-геномами двух высокоадаптированных ретровирусов позволяет им в изменяющихся условиях среды обитания совершать «эволюционно широкие прыжки». Традиционно семейство разделяют на подсемейства ленти-, онкорна- и спумавирусов. ВИЧ относится к подсемейству лентивирусов (Lentivirinae, «медленные вирусы»). Экзогенные ретровирусы интегрируясь с геномом хозяина, могут переходить в так называемые эндогенные ретровирусы (ERV) случайно инфицировав клетки зародышевой линии во время развития плода. В работе механизма такого «перехода» много неясного, тем не менее, он существует. ERV имеют дефекты, по крайней мере, в одном структурном гене, и не способны образовывать вирусные частицы, инфицирующие другие клетки. Амплификация копий «предкового» провируса осуществляется путем внутриклеточной ретротранспозиции и повторной интеграции в клетки зародышевой линии. Каждая новая колонизация таких клеток дает новое семейство или линию ERV. Кроме эндогенных ретровирусов геном человека содержит другие подобные структуры — ретроэлементы. Общим для них является то, что они кодируют обратную транскриптазу и перемещаются по геному через образование РНК-транскрипта. Образовавшийся транскрипт транскрибируется «обратно» в ДНК-транскрипт и встраивается в хромосому клетки. Структуры, подобные провирусу ВИЧ, обобщенно называемые ретроэлементами, составляют почти половину генома человека. Чтобы понять, что собой представляет сосуществование ретровирусов и позвоночных, я Вам предложу аналогию с фотографическим снимком. Вы вышли на улицу с фотоаппаратом и сделали снимок улицы с движущимися машинами, людьми, построенными домами и, даже, с только что выпавшим снегом. Сделаете снимок с этой точки через минуту, люди и машины уже будут другими, через час может не оказаться снега, через год уже могут стоять другие дома и т. д. Также и наши представления о «сосуществовании ретровирусов и позвоночных вообще, и человечества и ВИЧ в частности». Из-за масштаба времени, в которых происходят те или иные эволюционные процессы, эволюционная составляющая их «сосуществования» выпадает из «поля зрения» ученых. Поэтому если мы посмотрим на сегодняшний снимок указанных Вами четырех разноуровневых объектов, то они «замрут» каждый по отдельности: ВИЧ виде пандемического процесса, охватившего человечество; человечество в составе только одного вида с нескромным самоназванием Homo sapiens; позвоночные и их ретровирусы — это современный животный мир, где первые являются «хозяевами», вторые их «паразитами» (по крайней мере, так принято интерпретировать их взаимоотношения друг с другом). Отодвинем горизонт времени на 100 тыс. лет назад и сделаем такой же «снимок». Разумеется, на «снимке» нет ни машин, ни дорог. Животный мир более разнообразен, а человечество представлено как минимум тремя видами. ВИЧ, возможно, не вызывает эпидемических процессов в их популяциях. Но в геноме многих представителей вида H. sapiens уже находится полноразмерная ДНК-копия ретровируса, прошедшего через эндогенизацию в зародышевой линии. Его сегодня мы называем HERV-K113. Этот эндогенный ретровирус свидетельствует о какой-то эпидемический катастрофе среди «людей» того времени, вызванной его экзогенным вариантом. Отодвинем горизонт времени еще на 2 млн лет, ситуация меняется более заметно. На новом «снимке» людей нашего антропологического типа нет, но фотографу «строит рожи» толпа из представителей десятка похожих на него видов, которых палеоантропологи объединяют под общим названием «гоминоиды». Объем их мозга уже приближается к объему мозга современного вида человека. Образовывали они какое-то единое человечество или нет, я не знаю. Палеогеновая фауна представлена многообразными видами млекопитающих, и в их гигантских формах с трудом угадываются нынешние слоны, тигры и прочие представители современной фауны. Полноразмерная копия HERV-K113 в геноме гоминоидов отсутствует, но геном вида, ставшего предковым для H. sapiens, уже содержит 31 семейство эндогенных ретровирусов человека (human endogenous retroviruses, HERV). Самый ранний из них интегрировался с зародышевой линией предкового для гоминоидов вида не менее чем 45 млн лет назад. Сам этот вид не попал в антропологический «поминальник», но ДНК-копия ретровируса, вызвавшего смертельную эпизоотию в его популяциях, сохранилась в геноме современного вида человека. Так постепенно мы отходим от тех наших предков, которые хотя бы отдаленно напоминают приматов вообще, и расширяем горизонт «снимка» до класса млекопитающих. Меловой период (135–66 млн лет назад) — по неизвестным причинам происходит вымирание рептилий. Млекопитающие занимают высвобождающиеся экологические ниши. Но рост их не только количественный, но и качественный, т. е. появляется много новых видов млекопитающих. Видообразование происходит при снижении конкуренции с уходящими «хозяевами планеты». Конкуренция считается одним из факторов естественного отбора в понимании эволюционного учения, сформулированного Чарльзом Дарвиным. Получается, что давление естественного отбора на млекопитающих снижается, но вместо размножения видов млекопитающих, имеющих сходные экологические потребности с вымирающими рептилиями, среди млекопитающих появляются все новые и новые виды. У такого процесса должны быть какие-то другие серьезные основания. Прежде всего, должен работать антиэнтропийный механизм, позволяющий раскручивать эволюционный маховик. Этот механизм может находиться только в геноме самих млекопитающих. Как раз в меловом периоде их геном усложняется за счет распространения ДНК-транспозонов (85 % от их общего количества; примерно 291 тыс. элементов). Тогда же активизировались такие ретроэлементы, как L1 и Alu. Alu «моложе», чем L1, но «пики» их размножения в эволюционно предшествующих человеку видах совпали примерно 60 млн лет. «Расцвет» млекопитающих пришелся на палеоген (66–25 млн лет назад). Эволюционные механизмы, запускаемые ретроэлементами генома позвоночных организмов, подробно описаны в моей книге «Эволюционная патология», вышедшей в ноябре 2009 года в издательстве «Вузовская книга» . На сайте выложены три главы ее последней рабочей версии. Процесс образования новых генетических структур за счет активности ретроэлементов я предлагаю назвать ретровирусной эволюцией. От нейтральной эволюции она отличается тем, что в ее основе лежат совершенно иные механизмы. Во-первых, мутации носят характер не отдельных точковых изменений в генах, а проявляются увеличением сложности генетических структур за счет транслокаций и тандемных дупликаций генетического материала клетки, экзонизации интронов и кластерной организации генов. Фенотипически этот процесс наращивания сложности генома проявляется увеличением у особи (вида) отдельных повторяющихся структур: молекулярных (V2- C2- и V1- C1-комбинации доменов иммуноглобулиновых белков); надмолекулярных (структура гемоглобина и ряда бактериальных токсинов); анатомических (увеличение количества члеников у членистоногих, позвонков у хордовых и др.). Во-вторых, в отличие от нейтральной эволюции, этот процесс не идет с постоянной скоростью не только у разных видов, но даже у особей одного и того же вида. Скорость ретровирусной эволюции зависит от инфицированности вида (особи) ретровирусами, частоты их эндогенизации, характера взаимодействия с эндогеннымии ретровирусами и ретроэлементами, «заполненности» генома ретровирусами и ретроэлементами, их «возраста» и от других подобных факторов. В третьих, ретровирусная эволюция, в отличие от нейтральной, ведет к «взрывному» появлению множества короткоживущих (в геологических эпохах, разумеется) видов. Продолжительность их существования зависит как от процессов, в которых участвуют ретровирусы и ретроэлементы (т. е. они сами могут оказаться факторами естественного отбора), так и от действия факторов внешней среды (экзогенных факторов эволюции), иначе говоря, естественного отбора в дарвиновском его понимании. Теперь рассмотрим то, как осуществляется сосуществование ретровирусов и позвоночных. Для понимания масштабов этого процесса нужно иметь ввиду следующее. Привычная нам шкала времени (месяцы, годы, столетия и даже тысячелетия) не позволяет охватить его целиком. Специалисты считают HERV «молодыми», если они «моложе» 6 млн лет, т. е. интегрировались с геномом гоминоидов уже после их дивергенции от предков современных обезьян. Поэтому процессы сосуществования ретровирусов с позвоночными правильнее оценивать во времени не по сроку жизни какого-то вида, а либо по геологическим эпохам, либо по продолжительности существования более общих таксономических категорий, например, семейств или даже классов. А вот взглянув на сосуществование ретровирусов и позвоночных с такой «высоты», мы обнаруживаем весьма любопытные детали, свидетельствующие о том, что ретровирусы, которые сегодня обнаруживают у различных представителей позвоночных, могут поддерживаться и вне представителей этого типа живых существ. Оказывается ретровирусы не только способны инфицировать геном позвоночных, но и многократно его реинфицировать. Например, тот самый HERV-K113, полноразмерная ДНК-копия которого «осела» в геноме современного вида человека не более чем 100 тыс. лет назад, уже инфицировал отдаленных предков приматов 30 млн. лет назад. Отдельные провирусы HERV-K, сохранившиеся после первого пришествия этого ретровируса в геном какого то вида, ставшего предшественником приматов Старого Света, периодически напоминают о себе вирусоподобными частицами, продуцируемыми клетками злокачественной опухоли человека — тератокарциномы. Неоднократно вовлекался в процесс эволюции приматов Старого Света и эндогенный ретровирус ERV9 — 38 млн лет назад и 8-6 млн лет назад. Да и сами HERV выявлены не только в геноме приматов, но и других позвоночных, появившихся раньше приматов. Что говорит об условности принятого названия этих эндогенных ретровирусов, связывающего их только с людьми и их эволюционными предками среди гоминоидов. Например, HERV-L обнаружен у мышей, кроликов, собак, кошек (общий предок — 100 млн лет назад), HERV-I — у птиц, рептилий и рыб (общий предок — 400 млн лет назад). Получены доказательства, по крайней мере, двух «взрывов» распространения ERV-L по геному мышей, но не крыс, имевших место менее чем 10 млн лет назад. Однако в геноме приматов ERV-L «обосновались» не менее чем 45 млн лет назад. Естественно, что мыши не могут быть эволюционной ветвью приматов и инфицировались они ERV-L уже после дивергенции их предкового вида на крыс и мышей. Поэтому объяснить наличие в их геноме копий этих ретровирусов вертикальной передачей от какого-то общего предка грызунов, а не от источника «вне вида», поддерживающего эти ретровирусы в экзогенном состоянии миллионы лет, весьма затруднительно. Тогда в каком хозяине поддерживаются экзогенные ретровирусы десятки (если не более) млн лет, что бы, как Вы выразились, «сосуществовать» с позвоночными? Вирусы не имеют белоксинтезирующего аппарата. Поэтому они не могут существовать вне клетки. Самыми простыми организмами, способными их поддерживать, являются одноклеточные. Их обнаружено тысячи видов, и они являются эволюционными предшественниками макрофагов многоклеточных организмов. И вот что любопытно и малоизученно применительно к задачам эпидемиологической науки. На поверхности, как простейших, так и макрофагов находятся сходные рецепторные структуры, сходным образом функционирующие. Например, группы поверхностных рецепторов, способных взаимодействовать со структурами, богатыми углеводом маннозой. Они получили общее название — маннозные рецепторы. Их присутствие на поверхности амебы необходимо для связывания микроорганизмов, инициирования их поглощения клеткой и доставки в лизосомы для переваривания. Туже роль маннозный рецептор выполняет и у макрофага (например, его «узнает» ВИЧ). Амебы в условиях in vitro реагируют на фактор некроза опухолей (TNF), интерлейкин-1бета (IL-1бета), интерлейкин-8 (IL-8) и циклооксигеназу-2 точно так же как нейтрофилы и макрофаги — т. е. как на хемоаттрактанты. Сигнальные молекулы, которые мы называем хемокинами и цитокинами, и их рецепторы, стали «средством общения» между простейшими задолго до появления нейтрофилов и макрофагов как клеток иммунной системы позвоночных организмов. ВИЧ взаимодействует этими рецепторными структурами макрофагов и потом, после проникновения в клетку, он ведет себя в зависимости от того, через какой рецептор он туда попал. Когда ВИЧ проникает в макрофаги посредством маннозного рецептора, он «ведет» себя как внутриклеточный эндосимбионт. Такая возможность у ВИЧ существует благодаря его поверхностному гликопротеину gp 120, лишь наполовину представляющему собой белковую молекулу. Когда ВИЧ проникает в клетку посредством рецептора CD4 и других хемокиновых рецепторов, специфически взаимодействующих с gp120 оболочки вируса, то его «поведение» в клетке становится другим — он начинает реплицироваться, активно используя ресурсы клетки, т. е. «превращается» в паразита. Сам ВИЧ кодирует ген белка, вызывающего хемотаксическую активность моноцитов человека — Nef. Внеклеточный Nef дозозависимо увеличивает миграцию моноцитов; благодаря этому механизму ВИЧ распространяется по организму человека. Такое сходство реакций простейших и макрофагов на хемокины и цитокины, наличие сходным образом функционирующих рецепторов у тех и у других, позволяет предположить, что ВИЧ и другие ретровирусы, способны поддерживаться в простейших и благодаря ним могут формировать первичные резервуары, которые могут существовать десятки миллионов лет. Экспериментально это положение никак пока не подтверждено из-за отсутствия соответствующей постановки задачи. Но в обстоятельствах появления вирусов иммунодефицита человека, обезьян (SIV) и кошачьих, содержатся косвенные подтверждения существования таких резервуаров Во-первых, азиатские виды диких приматов Старого Света (Colobines и макаки), так же как и отдельные африканские виды (бабуины), не являются носителями специфических SIV. Это наблюдение позволило некоторым ученым утверждать, что появление данного лентивируса среди приматов произошло из источника, не имеющего отношения к приматам и уже после их дивергенции на современные виды. Во-вторых, лентивирусные инфекции среди животных (кошачьи, приматы) в Центральной Африке распространились в те же сроки, что и ВИЧ среди людей. Сероэпидемические исследования африканских зеленых обезьян, завезенных на Карибские острова в XVII и XVIII столетиях, не выявили ни одного случая их инфицированости SIV, т. е. этот лентивирус не циркулировал среди приматов Центральной Африки, по крайней мере, еще два столетия назад. В третьих, лентивирусные инфекции могут быть эндемичны для отдельных территорий и проживающих на них видов млекопитающих. Например, львы, обитающие в национальном парке Серенгети (Serengeti, Танзания), почти на 100% FIV-серопозитивны, и среди них уже выявляются особи с иммунодефицитом и энцефалопатиями. Но львы в котловине Этош (Etosha Pan, Намибия) почти все серонегативны. Не завершились успехом интенсивные поиски серопозитивных особей среди шимпанзе Восточной Африки (P. t. verus или P. t. vellorosus). В четвертых, можно предполагать природную очаговость не только экзогенных, но и эндогенных ретровирусов. Возможно, термин «природная очаговость» в применении к HERV не очень удачен, но я не могу пока подобрать другого. Эндогенные ретровирусные инфекции также как и экзогенные, могут быть локализованы территориально. У жителей Соединенного Королевства HERV-К113 и HERV-К115 были обнаружены у 4,16% и 1,0%, соответственно. У жителей Центральной Африки эти величины возросли до 21,8% и 34,1%, соответственно. В Йемене они составили 8% и 7.14%; в Папуа Новой Гвинее 0% для обоих ретровирусов. Эти географические вариации показывают, что оба ретровируса относительно недавно интегрировались с геномом человека в результате какой-то ретровирусной эпидемии. Инфицирование ими людей произошло на одной территории. А вот при каких обстоятельствах, не очень понятно. Возможно, что до исхода предков современных людей из Африки. Тогда разница в инфицированности отдельных популяций обусловлена действием каких-то селективных факторов. Но возможно и то, что инфицирование людей экзогенными предками HERV-К113 и HERV-К115 произошло позже «исхода», и осуществлялось на отдельных территориях (например, в Центральной Африке) многократно. В пользу этой версии говорит отсутствие HERV-К113 и HERV-К115 у аборигенов Папуа Новой Гвинеи, заселивших эти острова несколько десятков тысяч лет назад. Более подробно о том, как ретровирусы формировали иммунную систему позвоночных, как теперь иммунная система человека способствует распространению ВИЧ по его популяциям, и о эволюционном значении этого процесса, рассказано в моей книге «Эволюционная патология». Теперь рассмотрим «сосуществование» человечества и ВИЧ, как Вы сказали, «в частности». Скорее всего, процесс распространения ВИЧ по популяциям современного вида человека не предполагает сосуществования «частности» в том смысле, что они будут существовать оба в том виде, как они существуют сегодня. В отличие от эпидемий, вызываемых возбудителями чумы или оспы, ВИЧ/СПИД-пандемия не имеет механизма самоторможения. Здесь я позволю себе отойти от понимания ВИЧ/СПИД-пандемии, как процесса, требующего соблюдения прав человека, бесплатной раздачи презервативо, одноразовых шприцов и «перекачки» денег налогоплательщиков в частные фонды. Посмотрим на него исходя из его эпидемических реалий. Возможны три варианта развития пандемии. Первый, когда она обрывается за счет вмешательства другой пандемии, вызванной высоконтагиозным возбудителем болезни, например, натуральной оспы. Второй — ее прекращение после 100 % инфицирования населения планеты. И третий, — это вариант эндогенизации ВИЧ. Благодаря клеткам иммунной системы инфицированных ВИЧ людей и вовлечению в этот процесс максимально возможного количества генотипов, как людей, так и ВИЧ, может произойти эндогенизация ВИЧ в зародышевой линии отдельных людей. В этом случае ВИЧ пополнит число «молодых» эндогенных ретровирусов типа HERV-К113 и HERV-К115. Эндогенизация ВИЧ в геноме географически изолированной популяции человека послужит толчком к изменению его эволюционной траектории. Механизм этого процесса может быть следующим. В условиях географической изоляции станет невозможным панмиксическое «перемешивание» генофонда людей с эндогенизировавшимся ВИЧ, с генофондом населения, у которого эндогенизация не возможна. Близкородственное скрещивание (инбридинг) увеличит количество новых эндогенных ретровирусов в геноме человека до какой-то критической массы, когда генетическая дивергенция вида станет необратимой (т. е. по сути, тут речь идет об аллопатрическом видообразовании). Сам же ВИЧ еще десятки поколений «новых людей» будет играть роль фактора стабилизирующего отбора, «закрепляющего» новый вид путем негативной селекции особей современного вида человека (надо пояснять, что значит «негативная селекция» в данном контексте?). Этот вариант развития событий, возможно, Вам покажется самым бредовым из трех. Но, как выразился один известный физик, научная гипотеза должна быть достаточно бредовой, что бы оказаться правдой. Наличие в геноме современного вида человека не менее 31 семейства других эндогенных ретровирусов, попавших туда в результате ретровирусных эпизоотий среди его давно вымерших и забытых эволюционных предков, как раз свидетельствует в пользу того, что такой вариант развития событий не только возможен, но и для Природы обычен. Что будет представлять собой новый вид человека, сказать трудно. Но в любом случае он не будет походить на выдумки художников-ламаркистов, изображающих человека будущего вроде макроцефала, нажимающего клавиши компьютера тоненькими пальчиками. http://www.supotnitskiy.ru/stat/stat52.htm Интересно? Поделитесь статьей с другими: |
ВИЧ | СПИД: Что Происходит?
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
с 2006 года |
||
|
При использовании материалов прямая активная гиперссылка на главную страницу Современного Портала о ВИЧ обязательна. Мнение администрации Портала может не совпадать со взглядами авторов материалов, публикуемых на сайте. Информация, опубликованная на сайте, носит справочный характер и не заменит профессиональной консультации специалиста. |
||















 Информационно-развлекательный портал
Информационно-развлекательный портал